Laju Reaksi
Pengertian Laju Reaksi
Laju reaksi mengacu pada kecepatan perubahan konsentrasi zat reaktan atau pembentukan zat hasil dalam suatu reaksi kimia. Dalam reaksi kimia, zat reaktan akan saling bertabrakan dan berinteraksi untuk membentuk produk baru. Laju reaksi dapat dipengaruhi oleh berbagai faktor, seperti suhu, konsentrasi zat, luas permukaan, dan keberadaan katalisator.
Faktor-faktor yang Mempengaruhi Laju Reaksi
Ada beberapa faktor yang dapat mempengaruhi laju reaksi, antara lain:
Suhu: Suhu yang tinggi akan meningkatkan kecepatan gerakan partikel-partikel zat, sehingga meningkatkan peluang bertabrakan dan mempercepat laju reaksi.
Konsentrasi: Semakin tinggi konsentrasi zat reaktan, semakin banyak partikel yang ada dalam volume yang sama, sehingga meningkatkan peluang bertabrakan dan mempercepat laju reaksi.
Luas Permukaan: Jika luas permukaan zat padat diperbesar, maka akan terjadi lebih banyak kontak dengan zat reaktan, sehingga meningkatkan peluang bertabrakan dan mempercepat laju reaksi.
Katalisator: Katalisator adalah zat yang dapat meningkatkan laju reaksi tanpa ikut bereaksi secara langsung. Katalisator bekerja dengan mengurangi energi aktivasi yang diperlukan untuk memulai reaksi, sehingga mempercepat laju reaksi.
Mekanisme Reaksi dan Laju Reaksi
Setiap reaksi kimia memiliki mekanisme reaksi yang berbeda-beda. Mekanisme reaksi adalah urutan langkah-langkah yang terjadi selama reaksi kimia. Laju reaksi dapat ditentukan oleh langkah yang paling lambat dalam mekanisme reaksi tersebut, yang dikenal sebagai langkah penentu.
Contohnya, dalam reaksi pembakaran kayu, mekanisme reaksi terdiri dari langkah penghantaran panas, reaksi antara oksigen dan kayu, dan pembentukan produk hasil reaksi. Jika langkah penghantaran panas adalah langkah penentu, maka laju reaksi akan bergantung pada kecepatan penghantaran panas tersebut.
Persamaan Laju Reaksi
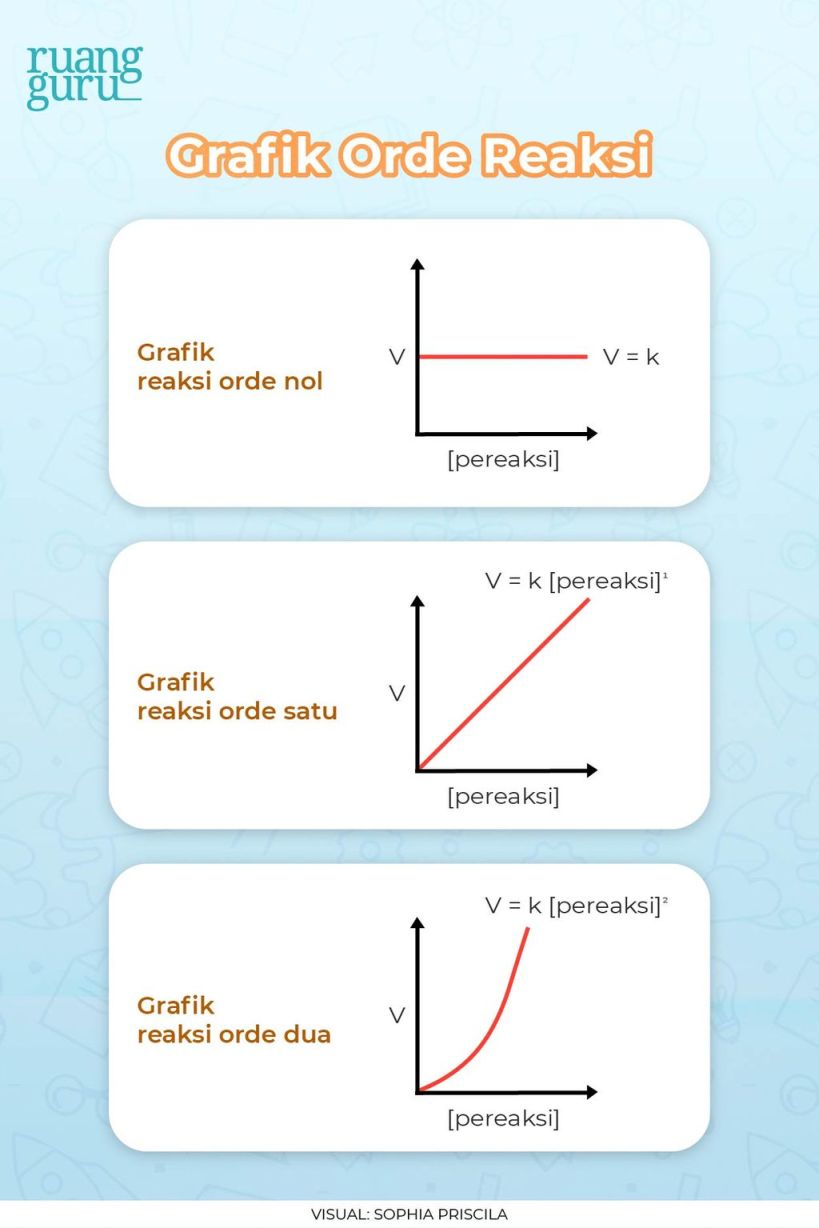
Persamaan laju reaksi menggambarkan hubungan antara laju reaksi dengan konsentrasi zat reaktan. Persamaan laju reaksi dapat dinyatakan sebagai:
laju reaksi = konsentrasi zat reaktan^x
Di mana x adalah orde reaksi terhadap zat reaktan. Orde reaksi dapat berupa bilangan bulat positif, nol, atau negatif.
Kesimpulan
Laju reaksi adalah kecepatan perubahan konsentrasi zat reaktan atau pembentukan zat hasil dalam suatu reaksi kimia. Faktor-faktor yang mempengaruhi laju reaksi meliputi suhu, konsentrasi zat, luas permukaan, dan keberadaan katalisator. Mekanisme reaksi dan persamaan laju reaksi juga memainkan peran penting dalam menentukan laju reaksi suatu reaksi kimia.
FAQ
1. Apa yang dimaksud dengan laju reaksi?
Laju reaksi mengacu pada kecepatan perubahan konsentrasi zat reaktan atau pembentukan zat hasil dalam suatu reaksi kimia.
2. Apa saja faktor-faktor yang mempengaruhi laju reaksi?
Faktor-faktor yang mempengaruhi laju reaksi antara lain suhu, konsentrasi zat, luas permukaan, dan keberadaan katalisator.
3. Bagaimana suhu mempengaruhi laju reaksi?
Suhu yang tinggi akan meningkatkan kecepatan gerakan partikel-partikel zat, sehingga meningkatkan peluang bertabrakan dan mempercepat laju reaksi.
4. Apa yang dimaksud dengan mekanisme reaksi?
Mekanisme reaksi adalah urutan langkah-langkah yang terjadi selama reaksi kimia.
5. Bagaimana persamaan laju reaksi dihitung?
Persamaan laju reaksi menggambarkan hubungan antara laju reaksi dengan konsentrasi zat reaktan.
Baca Juga: Alkana
