Sifat Koligatif Larutan
Pendahuluan
Larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Ketika suatu zat dilarutkan dalam pelarut, sifat-sifat larutan dapat berubah. Salah satu perubahan sifat yang terjadi adalah sifat koligatif larutan. Sifat koligatif larutan berkaitan dengan jumlah partikel yang terlarut dalam pelarut, bukan jenis partikel itu sendiri. Dalam artikel ini, akan dijelaskan lebih lanjut mengenai sifat koligatif larutan dan pengaruhnya terhadap larutan.
Penurunan Tekanan Uap
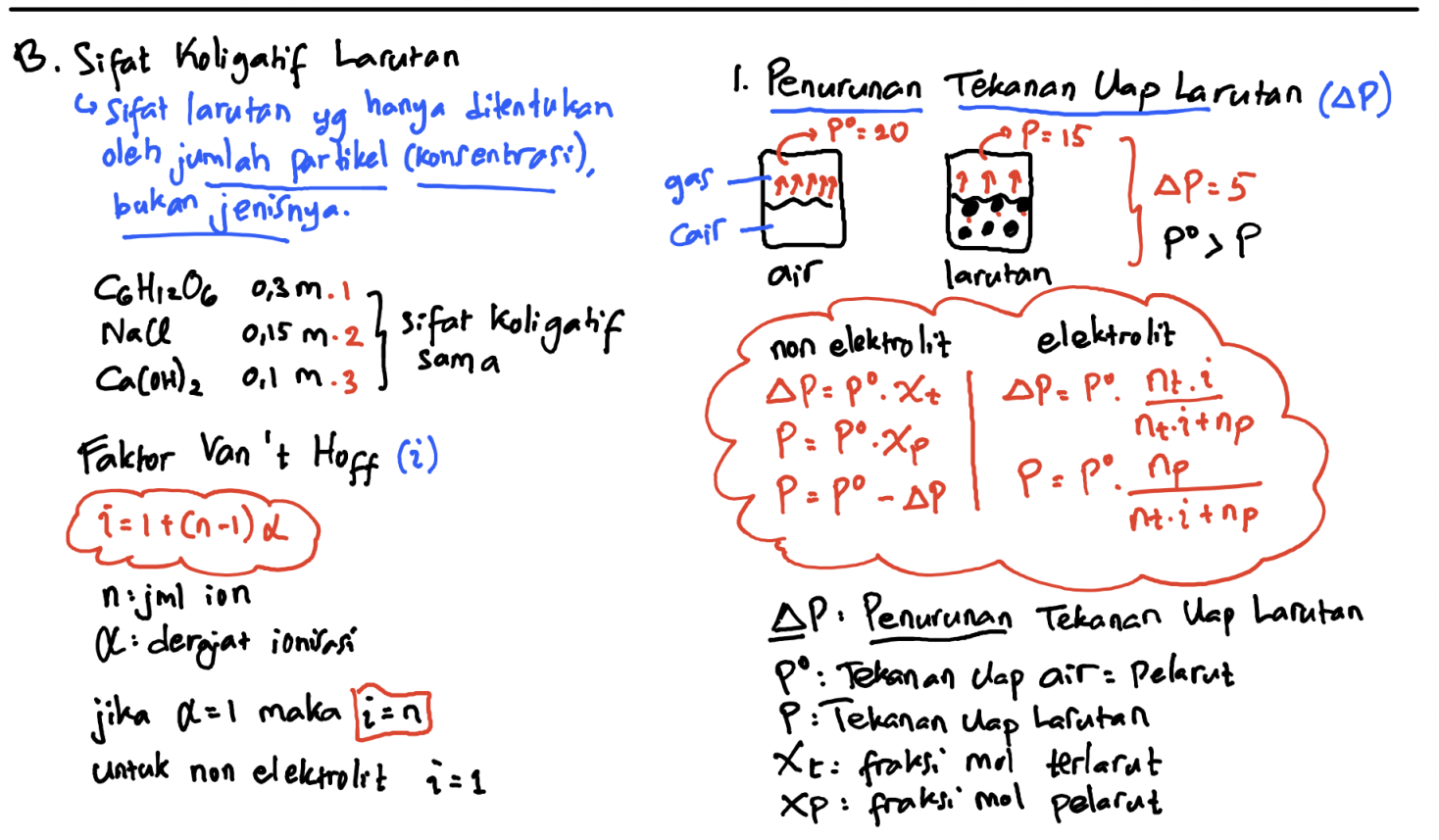
Sifat koligatif larutan yang pertama adalah penurunan tekanan uap. Ketika zat terlarut ditambahkan ke dalam pelarut, tekanan uap larutan akan lebih rendah dibandingkan pelarut murni. Hal ini disebabkan oleh adanya interaksi antara partikel-partikel zat terlarut dan pelarut yang menghalangi pelarut untuk menguap. Semakin banyak zat terlarut yang ditambahkan, semakin rendah tekanan uap larutan.
Kenaikan Titik Didih
Sifat koligatif larutan yang kedua adalah kenaikan titik didih. Ketika zat terlarut ditambahkan ke dalam pelarut, titik didih larutan akan lebih tinggi dibandingkan pelarut murni. Hal ini disebabkan oleh adanya interaksi antara partikel-partikel zat terlarut dan pelarut yang menghalangi pelarut untuk berubah menjadi uap. Semakin banyak zat terlarut yang ditambahkan, semakin tinggi titik didih larutan.
Penurunan Titik Beku
Sifat koligatif larutan yang ketiga adalah penurunan titik beku. Ketika zat terlarut ditambahkan ke dalam pelarut, titik beku larutan akan lebih rendah dibandingkan pelarut murni. Hal ini disebabkan oleh adanya interaksi antara partikel-partikel zat terlarut dan pelarut yang mengganggu struktur kristal pelarut saat membeku. Semakin banyak zat terlarut yang ditambahkan, semakin rendah titik beku larutan.
Osmosis
Sifat koligatif larutan yang keempat adalah osmosis. Osmosis adalah perpindahan pelarut dari larutan yang memiliki konsentrasi rendah ke larutan yang memiliki konsentrasi tinggi melalui membran semipermeabel. Hal ini terjadi karena adanya perbedaan konsentrasi antara dua larutan yang dipisahkan oleh membran semipermeabel. Osmosis memiliki peran penting dalam proses regenerasi sel, penyerapan air oleh akar tumbuhan, dan banyak proses biologis lainnya.
Pertanyaan FAQ
1. Apakah sifat koligatif larutan hanya berlaku untuk larutan cairan?
Tidak, sifat koligatif larutan berlaku untuk larutan apa pun, baik itu larutan cairan, larutan padat, atau larutan gas. Yang penting adalah jumlah partikel yang terlarut dalam pelarut.
2. Apa pengaruh suhu terhadap sifat koligatif larutan?
Suhu mempengaruhi sifat koligatif larutan, terutama kenaikan titik didih dan penurunan titik beku. Semakin tinggi suhu, semakin besar perubahan sifat koligatif larutan.
3. Bagaimana menghitung molalitas larutan?
Molalitas larutan dapat dihitung dengan membagi jumlah mol zat terlarut dengan massa pelarut dalam kilogram. Rumusnya adalah molalitas = jumlah mol zat terlarut / massa pelarut (kg).
4. Apakah sifat koligatif larutan dapat digunakan dalam kehidupan sehari-hari?
Tentu saja, sifat koligatif larutan memiliki banyak aplikasi dalam kehidupan sehari-hari. Contohnya, pemberian larutan infus, proses pembekuan es krim, dan pengawetan makanan menggunakan larutan garam.
5. Apakah ada sifat koligatif larutan lainnya selain yang telah disebutkan?
Ya, ada sifat koligatif larutan lainnya seperti tekanan osmotik dan dispersi koloid. Namun, dalam artikel ini hanya dijelaskan beberapa sifat koligatif larutan yang umum.
Baca Juga: Alkana
